OBJETIVOS: Medir experimentalmente la constante de los gases R.
MATERIALES:
- Tubo graduado
- Tapón agujereado
- Alambre de cobre
- Magnesio
- Ácido clorhídrico comercial
- Termómetro
- Vaso de precipitados grande
SEGURIDAD:
- No usar lentillas al manejar el ácido.
- Usa gafas de seguridad y guantes para manejar el ácido.
- El ácido clorhídrico comercial es fumante (desprende vapores de HCl). Evitar inhalarlo. Si es preciso, manejarlo bajo campana de gases o en lugar bien ventilado.
- El ácido clorhídrico es corrosivo, en caso de contacto con la piel, lavar con agua abundante.
PROCEDIMIENTO:
- Pesa uno de los trozos de magnesio en la balanza analítica. Si se aprecia signos de óxido (no está brillante y limpio), introducirlo brevemente en un poco de ácido clorhídrico:agua 1:1 para eliminarlo, enjuagarlo con agua y secarlo con papel antes de pesarlo.
- Engánchalo al hilo de cobre.
- Llena el vaso de precipitados grande con agua.
- Vierte unos 2 mL de ácido clorhídrico concentrado en el tubo graduado.
- Llénalo hasta arriba con agua, vertiendo ésta lentamente para evitar en lo posible la mezcla y difusión del clorhídrico concentrado, que, por su mayor densidad, permanecerá en el fondo del tubo.
- Coloca el tapón agujereado al tubo, haciendo que el trozo de magnesio enganchado al hilo de cobre quede dentro del tubo, y fijado por el tapón.
- Invierte rápidamente el tubo e introdúcelo en el vaso de precipitados anteriormente llenado con agua.
- Deja que la reacción transcurra: el gas liberado se acumula dentro del tubo, desplazando al agua, y posibilitando su medida.
- Una vez terminada la reacción, nivel el tubo verticalmente para hacer que el nivel del agua dentro y fuera coincidan. En ese momento, anota el volumen marcado por el gas en el tubo. Anota también la temperatura del agua y la presión atmosférica, que coincide con la del gas del interior del tubo.
- Los líquidos pueden tirarse por el desagüe.
- Repite el experimento completo con otros dos trozos de magnesio.
TAREAS:
- Averigua qué reacción tiene lugar entre el magnesio y el clorhídrico y cuál es la ecuación de los gases perfectos que nos va a permitir calcular R.
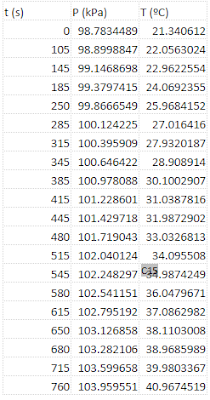
- Organiza los datos en una tabla. Ten en cuenta que el gas atrapado sobre agua contiene también vapor de agua, y por lo tanto la presión total (atmosférica) es la suma de la del gas producido y del vapor de agua. Para obtener la del gas, hay que restar la presión de vapor del agua a la temperatura medida, que debes buscarla en la bibliografía. Incluye en la tabla todos los datos necesarios para calcular R y el valor calculado para cada trozo de magnesio.
- Pon un ejemplo de los cálculos necesarios para calcular un valor de R.
- Calcula la media y desviación del valor de R medido.
- Compara el valor obtenido con la bibliografía y calcula la diferencia en tanto por ciento.
- Evalúa el procedimiento en cuanto a precisión y exactitud de los resultados. Expón detalladamente debilidades y fuentes de error del método y soluciones para las mismas.
RESULTADOS:
1. La reacción que ocurre cuando el magnesio y el clorhídrico hacen contacto es que el gas es liberado y se acumula dentro del tubo, desplazando así el agua.
La ecuación de los gases ideales es:
Si despejamos R, nos queda que R= p*T*Pat/m*T
2. Determinación de R
3. R= p*T*Pat/m*T
R= 0,973*0.0166*2/0.0164*294; R= 0.081 L*atm/K*mol
4. La media de R es 0.0815, y su desviación es de 0.0005.
EVALUACIÓN:
A pesar de estos dos errores y de las debilidades del método, el resultado de R es bastante aproximado al resultado real.
2. Determinación de R
3. R= p*T*Pat/m*T
R= 0,973*0.0166*2/0.0164*294; R= 0.081 L*atm/K*mol
4. La media de R es 0.0815, y su desviación es de 0.0005.
EVALUACIÓN:
A pesar de estos dos errores y de las debilidades del método, el resultado de R es bastante aproximado al resultado real.